A méhnyakrák elméletileg 100%-ban megelőzhető, de…
… még napjainkban is évente 400-500 nő hal meg méhnyakrákban Magyarországon (2021-es adat: 415 fő), és sajnos a rendszeres citológiai vizsgálat sem jelent teljes védelmet. A méhnyakrák ugyanis az esetek 24-32%-ában* olyan nőknél alakul ki, akik előzőleg jártak citológiai vizsgálaton alapuló nőgyógyászati szűrésre, és negatív eredménnyel rendelkeztek!
* Leyden et al. JNCI 2005; 97: 675 ill. Andrae et al. JNCI 2008; 100: 622
A rendszeres nőgyógyászati szűrővizsgálat – citológia – bár kétségkívül jelentős előrelépést hozott a méhnyakrák elleni küzdelemben – de még a magyarországinál hatékonyabb szűrőprogramokkal rendelkező országok esetében is azt tapasztalták, hogy a méhnyakrákos esetek előfordulása nem szorítható egy bizonyos szint alá. A mellékelt grafikonon* látható, hogy a citológiai vizsgálaton alapuló szűrés bevezetése ellenére a 100.000 lakosra jutó méhnyakrák előfordulás mindössze 50%-kal csökkent azokban az országokban, ahol a veszélyeztetett lakosság több mint 80%-a rendszeresen eljárt szűrésekre.
*A grafikon Anglia, Wales, Norvégia és Dánia adatai alapján készült (Quinn, 1999) Forrás: www.ecca.info
Mi ennek az oka?
A citológiai vizsgálat túl sok hibalahetőséget tartalmaz…
A citológiai vizsgálat nem a méhnyakrák okát, hanem a már látható tüneteket vizsgálja
Megoldás: ARTEMIS
Az ARTEMIS olyan kombinált szűrővizsgálat, amely a lehető legkevesebb szubjektív elemet (hibalehetőséget) tartalmazza, és a méhnyakrák kialakulásának okát, a HPV fertőzöttséget is vizsgálja. az ARTEMIS méhnyakrák szűrés három egymást kiegészítő tesztből áll:
Az ARTEMIS szűrés előnyei
Az ARTEMIS lehetséges eredményei és magyarázatuk
Felhívjuk szíves figyelmét, hogy az alábbi táblázatban szereplő ajánlások tájékoztató jellegűek, és nem helyettesítik a nőgyógyászával történő személyes konzultációt!
| ARTEMIS eredmény | Teendő | |
|---|---|---|
| Citológia* | hrHPV | |
| negatív | negatív | Az Ön esetében a méhnyakrák kialakulásának kockázata a következő 5 évben elhanyagolhatóan kicsi. Egy esetleges későbbi HPV-fertőzés veszélyének függvényében azonban – életmódjától függően – a nőgyógyásza által javasolt időpontban célszerű megismételni a szűrést. |
| pozitív
HSIL vagy HSIL gyanú |
pozitív,
hrHPV 16, 18, 31, 33, 45, 52 vagy 58 kimutatható |
Az Ön esetében a legmagasabb kockázatú hrHPV típusok jelenléte és a pozitív citológiai lelet (HSIL vagy HSIL gyanú) miatt feltétlenül szükséges kolposzkópiát, konizációt (kúpkimetszést) és/vagy biopsziát (mintavételt szövettani vizsgálathoz) végezni. Haladéktalanul keresse fel nőgyógyászát! |
| LSIL | pozitív,
hrHPV 16, 18, 31, 33, 45, 52 vagy 58 nincs jelen |
Az Ön esetében a citológiai vizsgálat kismértékű elváltozást mutat, és magas kockázatú hrHPV vírusok is jelen vannak a mintában. Bár a legveszélyesebb hrHPV vírusok nem kimutathatók, ennek ellenére a hüvelytükrözés (kolposzkópia) javasolt, amelyet a nőgyógyásza tud elvégezni. Pozitív kolposzkópia esetén szövettani mintavétel szükséges, negatív kolposzkópia esetén 6 hónap múlva javasolt megismételni az ARTEMIS vizsgálatot. |
| ASC-US ASC-H | pozitív
hrHPV 16, 18, 31, 33, 45, 52, 58 nincs jelen |
Az Ön esetében a kenetből kimutatott módosult laphámsejtek és magas kockázatú hrHPV vírusok miatt – a biomarker vizsgálat eredményének függvényében – 6-12 hónap múlva javasolt az ARTEMIS szűrővizsgálat megismétlése. Szerencsére a legveszélyesebb HPV vírusok nincsenek jelen. |
| pozitív
HSIL vagy HSIL gyanú |
negatív | Az Ön esetében magas kockázatú HPV típusok nem kimutathatók, de a citológiai vizsgálat eredménye alapján kolposzkópia (hüvelytükrözés) szükséges, amelyet a nőgyógyásza tud elvégezni. Negatív kolposzkópia esetén 12 hónap múlva az ARTEMIS szűrés megismétlése javasolt. Pozitív kolposzkópia esetén szövettani mintavétel szükséges. |
| negatív | pozitív,
hrHPV 16, 18, 31, 33, 45, 52 vagy 58 kimutatható |
Az Ön esetében a legmagasabb kockázatú hrHPV típusok jelenléte miatt – a citológiai eredménytől függetlenül – 6 havonta javasolt ismételni a szűrést. |
* Intézményünkben a mára elavultnak számító Papanicolaou értékelési rendszert a citológiai eredmény megállapításánál nem használjuk
A CONFIDENCE Marker metilációs vizsgálat lehetséges eredményei és magyarázatuk
| Metilációs szint | Értelmezés |
|---|---|
| ALACSONY (-) | A méhnyakrák megelőző állapotra vagy rákos megbetegedésre vonatkozóan nem jelent emelkedett kockázatot. 12 hónap múlva kontroll vizsgálat javasolt. A páciens kockázata a méhnyakrák megelőző állapotra vagy rákos megbetegedésre a vizsgálat idejében nem magasabb, mint egy kezdődő HPV-fertőzés kockázata, utánkövetés javasolt. |
| EMELKEDETT (+) | A méhnyakrák megelőző állapotra vagy rákos megbetegedésre vonatkozóan EMELKEDETT KOCKÁZATOT jelent. 6 hónap múlva kontroll vizsgálat javasolt. A páciens kockázata a méhnyakrák megelőző állapotra vagy rákos megbetegedésre a vizsgálat idejében magasabb, mint egy kezdődő HPV-fertőzés kockázata, de még nem indikál azonnali szövettani mintavételt, utánkövetés javasolt. |
| MAGAS (++) | A páciens kockázata a méhnyakrák megelőző állapotra vagy rákos megbetegedésre a vizsgálat idejében magas, azonnali visszahívást, kolposzkópiát és utóbbi eredményétől függően szövettani mintavételt tesz szükségessé. Negatív kolposzkópia estén a beteg szoros utánkövetése javasolt. |
Az ARTEMIS méhnyakrák szűrés segítségével a méhnyakrák valóban megelőzhető!
Az ARTEMIS teszt negatív predikciós értéke 99,92%*, ami azt jelenti, hogy negatív teszt esetén a páciens esélye a CIN3 rákmegelőző állapot kialakulására az elkövetkező 5 évben mindössze 0,08%.
* Katki et al.: Benchmarking CIN3+ risk as the basis for incorporating HPV and Pap cotesting into cervical screening and management
Kinek javasolt az ARTEMIS méhnyakrák szűrés?
A teszt minden olyan 25-65 év közötti nőnek javasolt, aki el szeretné kerülni a méhnyakrák kialakulását.
Az időben felfedezett HPV fertőzést követően ugyanis a szükséges nőgyógyászati beavatkozások még azelőtt elvégezhetők, mielőtt az érintett sejtek a rákos állapotig eljutnának. A szexuálisan aktív hölgyeknek – életmódtól függő gyakorisággal – negatív ARTEMIS eredmény esetén is javasolt a rendszeres, HPV szűréssel kombinált méhnyakszűrés, az esetleges friss HPV fertőzés mielőbbi detektálása érdekében.
65 év feletti nők esetében – ha az utolsó három szűrés eredménye negatív volt – már nem szükséges a HPV vizsgálat.
ARTEMIS méhnyakrák szűrés háttéranyagok
Gyakran Ismételt Kérdések
A méhnyakrák hátterében a HPV fertőzés áll
Az utóbbi évtizedek tudományos eredményei egyértelműen bizonyították, hogy a méhnyakrák kialakulásának elsődleges oka a HPV (human papilloma vírus) fertőzés, a megbetegedések több mint 95%-áért ez a vírus tehető felelőssé. A hosszabb ideje HPV-vel fertőzött személyeknél ugyanis megindul a hámsejtek transzformációja, amelynek eredményeképpen az esetek többségében méhnyakrák, ritkábban más ráktípusok (szeméremtestrák, méhrák, petefészekrák, végbélrák, fej-nyaki dagantok stb.) fejlődnek ki.
Milyen gyakori a HPV fertőzés?
A HPV-fertőzésen az emberek jelentős része (több mint 80%-a!) élete egy szakaszában átesik, pl. a nem stabil párkapcsolatban élő, szexuálisan aktív hölgyek körében a fertőzöttség mintegy 30-40%-os. Mivel a HPV-fertőzés sokszor nem okoz tünetet, a legtöbb férfi és nő úgy kapja el és adja tovább, hogy észre sem veszi.
A HPV fertőzésből meg lehet gyógyulni?
Igen. Szerencsére a fertőzést a szervezet ill. az immunrendszer legtöbbször 1-2 év alatt legyőzi, néhány esetben azonban tartósan megmarad a vírus. Kóros elváltozást az azonos, magas kockázatú hrHPV típussal való hosszú időn át tartó fertőzés okozhat, éppen ezért nem kell megijedni HPV-fertőzés esetén, hanem figyelemmel kell kísérni annak lezajlását.
A fertőzést követően tehát több év is eltelik, mire a kóros sejtburjánzás következtében méhnyakrák alakulhat ki.
Milyen típusai vannak a HPV fertőzésnek?
A HPV-fertőzést a méhnyakrák vagy más, HPV-vel összefüggésbe hozható ráktípusok kialakulása szempontjából két csoportba sorolják.
- Az egyik az ún. magas kockázatú (high risk) HPV, ebbe a csoportba a 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 66, 68-as típusok tartoznak. Ezek közül is kiemelkedően magas kockázatot hordoz a 16-os, a 18-as, 31-es és 33-as típus, az ARTEMIS vizsgálat részét képező hrHPV kimutatás ezek jelenlétét külön-külön is jelzi.
- A másik csoport a rák kialakulása szempontjából jelentéktelen kockázatot hordoz, ide tartozik az összes többi HPV típus. Ezek a vírusok jellemzően condylómákat, szemölcsöket okoznak.
Mely korosztályok veszélyeztetettek a HPV eredetű méhnyakrák szemponjából?
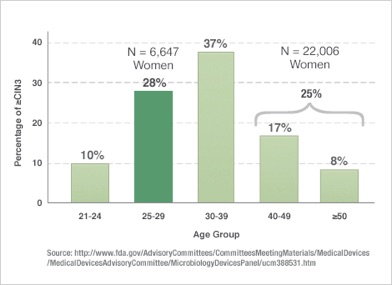
A CIN3 rákmegelőző állapot 28%-a a 25-29 éves korosztályban fordul elő, 37%-a a 30-39 éves korosztályban. Az idősebb korosztályban a stabil pár- ill. szexuális kapcsolatok kialakulásának köszönhetően csökken a HPV-vel való újrafertőződés gyakorisága, de mivel a méhnyakrák kialakulása hosszú évekig tarthat, magának a méhnyakráknak az előfordulása épp a 40-45 éves korosztályban a legmagasabb.
Megelőzhető a HPV fertőzés?
Nagyobbrészt igen, mert a legmagasabb kockázatú HPV típusok ellen létezik védőoltás, ami 2014 őszétől Magyarországon is ingyenesen kaphatnak meg a 7. osztályos – 12. évüket betöltött – lányok, de az oltás minden szexuálisan aktív nő számára javasolt.
Számos országban már rendelkezésre állnak azok az adatok, amelyek az ingyenessé tett HPV védőoltás bevezetése óta keletkeztek, és egyértelműen jelzik, hogy a beoltott korosztálynál a HPV eredetű elváltozások (pl. condylomák, nemi szemölcsök) gyakorisága töredékére esett vissza. Hosszabb távú klinikai vizsgálati adatok azonban a méhnyakrák kockázat és a HPV-oltás összefüggéseiről egyelőre nem állnak rendelkezésünkre, ezért a HPV oltásban részesültek méhnyakrák szűrési protokollja megegyezik a nem beoltottakéval, azaz jelenleg ugyanolyan gyakorisággal javasolt méhnyakrák szűrésre járniuk.
A citológiai vizsgálat során milyen módszert alkalmaznak a Papanicolaou értékelési rendszer helyett? Ez miért jobb vagy előremutatóbb?
A Papanicolaou rendszer 1943-ban született, 1998 óta a világon mindenütt az un. Bethesda klasszifikációt használják, kivéve néhány országot, beleértve Magyarország egyes laborjait is, annak ellenére, hogy ezt az elavult rendszert nem lenne szabad alkalmazni. Tény, hogy egy P számot közölni a pácienssel egyszerűbb, mint elmagyarázni a Bethesda leletet.
Mi a Bethesda klasszifikáció?
1988 decemberében a Maryland államban levő Bethesda városában ült össze néhány gyakorlott citopatológus – köztük Bodó Miklós professzor- Robert Kurman vezetésével, hogy egységesítsék a használt cervix citológiai nomenklatúrákat. A tanácskozás elsődleges célja az volt, hogy feloldják az ellentmondást a korábbi PAP osztályozás és a diszplázia fogalmát használó modern nomenklatúra között.
Az első Bethesda atlasz az 1991-es Bethesda workshop után, 1994-ben jelent meg és világszerte kedvező fogadtatásra talált. A világ legtöbb országában ezt a klasszifikációt használják, tudományos közlemény, melyben a citológiai eredményeket Papanicolaou szerint osztályozzák, gyakorlatilag nem jelenhet meg.
A Bethesda klasszifikáció legfőbb eredménye hogy egységes nyelvet, azaz terminológiát hozott létre a citológiai laboratórium és a beteget ellátó orvos, onkológus, nőgyógyász között.
Ez a terminológia egységes és reprodukálható különböző laboratóriumok és citopatológusok között , leíró, szövettani nomenklatúrában használatos terminológiával rendelkezik, egységes, ugyanakkor megfelelően flexibilisen illeszthető a már működő rendszerekhez.
A Bethesda terminológia összegzi a legújabb ismereteket a cervix karcinómára vonatkozóan, azaz az összefüggést a HPV infekció és a kialakuló hámelváltozások között. A laphám prekancerózus elváltozásait mindössze két kategóriára bontotta, az LSIL és a HSIL kategóriákra, tükrözve a HPV indukálta karcinogenezis fázisait, a reproduktív szakban ugyanis csak LSIL észlelhető, a HSIL-ek a perszisztáló és a transzformált szakra jellemzőek.
Igen nagy jelentőségű az is, hogy a Bethesda klasszifikáció használatakor ki kell térni a kenet minőségi jellemzőire is, ez alapvető minőségbiztosítási követelmény.
A Bethesda klasszifikáció leíró, szövettani szintű terminológiájához képest nyilvánvaló, hogy a Papanicolaou osztályozás idejét múlt, használata kerülendő, sőt kifejezetten veszélyes, a két klasszifikáció pedig nem kompatibilis, együttes használatuk magyar sajátosság, korszerű laboratórium a Papanicolaou klasszifikációt lehetőleg nem alkalmazza.
A Bethesda rendszer 2001-ben és 2014-ben revízióra került, számos módosítást vezettek be, az alapfelfogás azonban nem változott.
A 2001-es módosítások közül a legfontosabb, hogy nem diagnózisnak, hanem eredménynek aposztrofálja a citológiai vizsgálat végkövetkeztetését, hiszen a PAP teszt csak egy részét képezi a méhnyak szűrésnek, ebbe a folyamatba kell beilleszteni a vizsgálat eredményét, a végső diagnózist a kolposzkópia, esetleges biopszia, klinikai adatok, egyéb laboratóriumi vizsgálatok, pld HPV DNS teszt ismeretében lehet megadni.
A nomenklatúrát kiterjesztették az alsó genitális traktus, vagina, anus, gáttájék HPV okozta laphám elváltozásainak leírására is.
1991 és 2001 között számos újítást vezettek be a méhnyak szűrésbe, a folyadék alapú citológiai vizsgálatokat, a kenetek komputer általi automatikus kiértékelését, HPV tesztet, és ezeket a módszereket is beillesztették a rendszerbe. A kiadott Bethesda atlaszt számos kiegészítő ábrával, hisztológiai összefüggéseket bemutató képpel egészítették ki és elérhetővé vált az interneten is méghozzá interaktiv formában, ami az oktatást és a minőségbiztosítást szolgálta oly módon, hogy a vizsgáló módszer reprodukálhatósága és az interobszerver szórás mértéke mérhetővé vált.
Ha a leleten az szerepel hiányzik az endocervicalis átmeneti zóna akkor tekinthető-e az eredmény relevánsnak? Az esetek hány százalékában fordul elő, hogy hiányzik az endocervicalis átmeneti zóna? Mi az oka ennek? Ismételni kell-e/ajánlott-e a vizsgálatot ilyen esetben?
A leletezőnek nyilatkoznia kell arról, hogy a kenet tartalmaz-e endocervikális hengerhámsejteket, vagy az átmeneti zónából származó metaplasztikus laphámsejteket, ezen sejtek hiánya miatt a kenet nem értékelhetetlen, a nőgyógyász kompetenciája hogy megismétli a vizsgálatot, vagy elfogadja teljes értékűnek, ugyanis bizonyos kor felett, illetve anatómiai okokból nem mindenkiből nyerhetünk sejteket az átmeneti zónából.
A lelethez tartozik-e a laikus számára is érthető szöveges kiértékelés, ahhoz hasonló amit itt a honlapon is látni lehet?
A lelet értelmezését, elmagyarázását nőorvosának kell megtennie, ha a páciensnek bármi további kérdése van, honlapunkon keresztül felteheti.